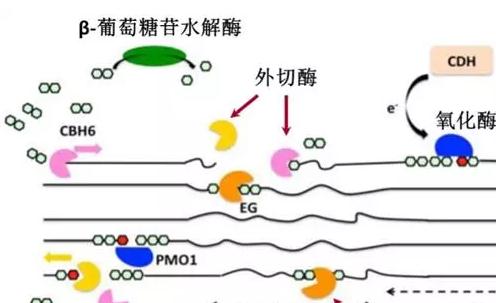
例如,來自里氏木霉的纖維素酶復合物包含標記為C1的組分(57,000道爾頓),其分離結晶纖維素鏈、內切葡聚糖酶(約52,000道爾頓)、外切葡聚糖酶(約61,000道爾頓)和β-葡糖苷酶(約61,000道爾頓)道爾頓)。
在產生纖維素體的細菌基因組中已經鑒定出許多被稱為dockerins和cohesins的“特征”序列。根據它們的氨基酸序列和三級結構,纖維素酶分為氏族和科。
由于酶與纖維素底物之間的緊密接近,多模塊纖維素酶比游離酶(只有CD)更有效,這是由于協同作用。CBM參與纖維素的結合,而糖基化接頭為CD提供靈活性,以提高活性和蛋白酶保護,并增加與纖維素表面的結合。
 咨詢熱線:0632-3279666
咨詢熱線:0632-3279666  城市分站
城市分站  聯系我們
聯系我們 


 郵箱:ren6669@126.com
郵箱:ren6669@126.com  電話:0632-3279666
電話:0632-3279666 
 地址:山東省棗莊市市中區孟莊鎮工業園區移山路6號
地址:山東省棗莊市市中區孟莊鎮工業園區移山路6號 
